No estudo da combustão, existem dois tipos de temperatura adiabática de chama, dependendo de como o processo é concluído: a volume constante e à pressão constante, os quais descrevem a temperatura e os produtos de combustão teoricamente obtidos se nenhuma energia for perdida para o ambiente externo.
A temperatura adiabática de chama a volume constante é a temperatura que resulta de uma combustão completa que ocorre sem qualquer trabalho, transferência de calor nem alterações nas energias cinética e potencial. A temperatura adiabática de chama à pressão constante é a temperatura que resulta de uma combustão completa que ocorre sem qualquer transferência de calor nem alterações nas energias cinética e potencial. Sua temperatura é mais baixa do que a de volume constante, pois parte da energia é utilizada para alterar o volume do sistema (isto é, para gerar trabalho).
Combustíveis comuns
No cotidiano, a grande maioria dos combustíveis é derivada de compostos orgânicos, incluindo madeira, cera, gordura, plásticos comuns, propano e gasolina. A temperatura adiabática de chama à pressão constante dessas substâncias no ar encontra-se num intervalo estreito próximo a 1950°C. Isso ocorre porque, em termos de estequiometria, a combustão de um composto orgânico com n carbonos envolve a quebra de cerca de 2n ligações C–H, n ligações C–C e 1,5n ligações O2 para formar cerca de n moléculas de CO2 moléculas e n moléculas de H2O.
Como a maioria dos processos de combustão que acontecem naturalmente ocorre ao ar aberto, não há nada que confine o gás em um volume específico, diferentemente do que ocorre no cilindro de um motor. Consequentemente, essas substâncias queimarão a uma pressão constante, permitindo que o gás se expanda durante o processo.
Temperaturas de chamas comuns[editar | editar código-fonte]
Supondo que a condição inicial atmosférica seja de 1 bar e 20°C, a tabela a seguir lista a temperatura adiabática de chama para vários gases sob pressão constante. As temperaturas mencionadas aqui são para um mistura estequiométrica entre combustível e comburente(razão ar–combustível φ = 1).
Estas temperaturas de chama são teóricas, não reais, produzidas por uma chama que não perde calor para o ambiente. A região mais próxima a esta temperatura é a parte mais quente da chama, onde a reação de combustão é mais eficiente. Também se pressupõe que a combustão seja completa (perfeitamente equilibrada, não fumegante, geralmente azulada).
| Combustível | Comburente | (°C) | (°F) |
|---|---|---|---|
| Acetileno (C2H2) | Ar | 2500 | 4532 |
| Acetileno (C2H2) | Oxigênio | 3480 | 6296 |
| Butano (C4H10) | Ar | 1970 | 3578 |
| Cianogênio (C2N2) | Oxigênio | 4525 | 8177 |
| Dicianoacetileno (C4N2) | Oxigênio | 4990 | 9010 |
| Etano (C2H6) | Ar | 1955 | 3551 |
| Etanol (C2H5OH) | Ar | 2082 | 3779[1] |
| Gasolina | Ar | 2138 | 3880 |
| Hidrogênio (H2) | Ar | 2254 | 4089 |
| Hidrogênio (H2) | Oxigênio | 3200 | 5792[2] |
| Metano (CH4) | Ar | 1963 | 3565[3] |
| Metanol (CH4OH) | Ar | 1949 | 3540 |
| Gás natural | Ar | 1960 | 3562[4] |
| Pentano (C5H12) | Ar | 1977 | 3591 |
| Propano (C3H8) | Ar | 1980 | 3596[5] |
| Propano (C3H8) | Oxigênio | 2526 | 4579 |
| Gás MAPP
Metilacetileno (C3H4)
| Ar | 2010 | 3650 |
| Gás MAPP
Metilacetileno (C3H4)
| Oxigênio | 2927 | 5301 |
| Tolueno (C7H8) | Ar | 2071 | 3760 |
| Madeira | Ar | 1980 | 3596 |
| Querosene | Ar | 2093[6] | 3801 |
| Óleo combustível leve | Ar | 2104 | 3820 |
| Petróleo | Ar | 2101 | 3815 |
| Óleo combustível pesado | Ar | 2102 | 3817 |
| Hulha | Ar | 2172 | 3943 |
| Antracito | Air | 2180 | 3957 |
| Antracito | Oxigênio | ~2900[nota 1] | ~5255 |
| Alumínio | Oxigênio | 3732 | 6750 |
| Lítio | Oxigênio | 2438 | 4420 |
| Fósforo branco | Oxigênio | 2969 | 5376 |
| Zircônio | Oxigênio | 4005 | 7241 |
- ↑ A temperatura igual a aproximadamente 3200 K corresponde a 50% da dissociação química de CO2 na pressão de 1 atm. Este último permanece invariável, constituindo 97% do total de fumos liberados no caso do antracito queimado em oxigênio. Temperaturas mais elevadas podem ocorrer em reações sob altas pressões.
Termodinâmica[editar | editar código-fonte]
A partir da primeira lei da termodinâmica, para um sistema fechado em reação, tem-se que:
- x
- Δe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
xsistema de dez dimensões de Graceli.xsistema de transições de estados, e estados de Graceli,xT l T l E l Fl dfG lN l El tf lP l Ml tfefelTa l RlLlD
onde e são o calor e o trabalho transferidos do sistema para o ambiente durante o processo, respectivamente, e e são a energia interna dos reagentes e dos produtos, respectivamente.
No caso da temperatura adiabática de chama a volume constante, o volume do sistema é mantido constante, portanto não ocorre nenhum trabalho:
- x
- Δe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
xsistema de dez dimensões de Graceli.xsistema de transições de estados, e estados de Graceli,xT l T l E l Fl dfG lN l El tf lP l Ml tfefelTa l RlLlD
e também não há transferência de calor, pois o processo é adiabático: . Como resultado, a energia interna dos produtos é igual à energia interna dos reagentes: .
x
Δe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
x
x
sistema de dez dimensões de Graceli.
x
sistema de transições de estados, e estados de Graceli,
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D
Como esse é um sistema fechado, a massa dos produtos e dos reagentes é constante, com a primeira lei podendo ser escrita com base nela:
- x
- Δe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
xsistema de dez dimensões de Graceli.xsistema de transições de estados, e estados de Graceli,xT l T l E l Fl dfG lN l El tf lP l Ml tfefelTa l RlLlD
No caso da temperatura adiabática de chama à pressão, a pressão do sistema é mantida constante, o que resulta na seguinte equação para o trabalho:
x
Δe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
x
x
sistema de dez dimensões de Graceli.
x
sistema de transições de estados, e estados de Graceli,
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D
Novamente não há transferência de calor ocorrendo, uma vez que o processo foi definido como adiabático: . A partir da primeira lei, tem-se que:
- x
- Δe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
xsistema de dez dimensões de Graceli.xsistema de transições de estados, e estados de Graceli,xT l T l E l Fl dfG lN l El tf lP l Ml tfefelTa l RlLlD
A partir da definição de entalpia, conclui-se que . Dado que esse é um sistema fechado, a massa dos produtos e dos reagentes é constante, e a primeira lei pode ser escrita com base nela:
x
xΔe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
x
sistema de dez dimensões de Graceli.
x
sistema de transições de estados, e estados de Graceli,
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D
Nota-se que a temperatura adiabática de chama à pressão constante é menor do que a temperatura a volume constante. Isso ocorre porque parte da energia liberada durante a combustão é usada para alterar o volume do sistema de controle. Uma analogia que é comumente feita entre os dois processos é pela combustão em um motor de combustão interna. Para o processo adiabático em volume constante, supõe-se que a combustão ocorre instantaneamente assim que o pistão atinge o ponto morto superior (ciclo de Otto ou ciclo do volume constante). Para o processo adiabático em pressão constante, enquanto a combustão está ocorrendo o pistão está se movendo a fim de manter a pressão constante (ciclo de Diesel ou ciclo da pressão constante).
Supondo que a combustão é completa (ou seja, que são liberados apenas CO2 e H2O), é possível calcular a temperatura adiabática de chama em condições estequiométricas ou numa mistura "pobre" (com excesso de ar). Isso se deve pela suficiente quantidade de variáveis e equação molares para balancear em ambos os lados:
- x
- Δe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
xsistema de dez dimensões de Graceli.xsistema de transições de estados, e estados de Graceli,xT l T l E l Fl dfG lN l El tf lP l Ml tfefelTa l RlLlD
Como a mistura ainda está "rica", não há variáveis suficientes sem que pelo menos se adicione CO e H2 necessários para o balanço molar (produtos mais comuns de uma combustão incompleta):
- x
- Δe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
xsistema de dez dimensões de Graceli.xsistema de transições de estados, e estados de Graceli,xT l T l E l Fl dfG lN l El tf lP l Ml tfefelTa l RlLlD
No entanto, se for levada em conta a reação de mudança do vapor de água:
- x
- Δe, ΔM, Δf, ΔE, Δt, Δi, ΔT, ΔC, ΔE,ΔA, ΔD, ΔM...... =
xsistema de dez dimensões de Graceli.xsistema de transições de estados, e estados de Graceli,xT l T l E l Fl dfG lN l El tf lP l Ml tfefelTa l RlLlD
e usar a constante de equilíbrio para esta reação, haverá variáveis suficientes para concluir o cálculo.
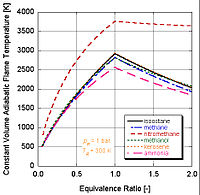
Diferentes combustíveis com diferentes níveis de energia e constituintes molares resultam em diferentes temperaturas adiabáticas de chama.
É possível ver na figura a seguir por que o nitrometano (CH3NO2) é frequentemente utilizado como um gerador de energia em carros. Uma vez que cada mol de nitrometano contém dois mols de oxigênio, ele pode queimar com uma menor quantidade de ar, pois fornece seu próprio oxidante junto com o combustível. Isso permite que acumule mais pressão durante um processo a volume constante. Quanto maior a pressão, maior a força sobre o pistão, que por conseguinte gera mais trabalho e potência no motor. A mistura permanece relativamente "rica" devido à presença de um próprio oxidante; no entanto, o contínuo funcionamento de um motor a nitrometano eventualmente levará ao derretimento do pistão ou do cilindro devido à alta temperatura.
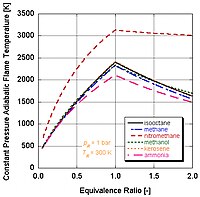
Em aplicações reais, a combustão completa não ocorre normalmente. A química determina que a dissociação e a cinética mudarão a constituição relativa dos produtos. Há uma série de programas que podem calcular a temperatura adiabática de chama levando em conta dissociações pelas constantes de equilíbrio (Stanjan, NASA CEA, AFTP). A figura a seguir ilustra os como os efeitos da dissociação tendem a diminuir o temperatura adiabática da chama. Esse resultado pode ser explicado pelo princípio de Le Châtelier.
observação: é usado textos da wikipédia para mostrar as modificações com as variáveis do sistema decadimensional e categorial Graceli.
teoria da relatividade categorial Graceli
ENERGIA, MASSA, FENÔMENOS, ESPAÇO, TEMPO, INTERAÇÕES, TRANSFORMAÇÕES, CONDUTIVIDADE, EMISSÕES, ABSORÇÕES, DIFRAÇÃO, MOMENTUM.
x
sistema de dez dimensões de Graceli.
x
sistema de transições de estados, e estados de Graceli,
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D
NO SISTEMA CATEGORIAL DE GRACELI TODO TIPO DE MOVIMENTO TEM AÇÃO TRANSFORMADORA [como os outros elementos, como temperatura, radioatividade, luz, e outros],SOBRE ESTRUTURAS E ENERGIAS, TEMPO E ESPAÇO, INÉRCIA E GRAVIDADE, LUZ .
Estados de Graceli de matéria, energias, momentuns, inércias, e entropias.
Estados térmico.
Estado quântico.
De dilatação.
De entropia.
De potencia de entropia e relação com dilatação.
De magnetismo [correntes, momentum e condutividades]..
De eletricidade [correntes, momentum e condutividades].
De condutividade.
De mometum e fluxos variados.
De potencial inercial da matéria e energia.
De transformação.
De comportamento de cargas e interações com elétrons.
De emaranhamentos e transemaranhamentos.
De paridades e transparidades.
De radiação.
Radioatividade.
De radioisótopos.
De relação entre radioatividade, radiação, eletromagnetismo e termoentropia.
De capacidade e potencialidade de resistir a pressão, a capacidade de resistir a pressão e transformar em entropia e momentum.
De resistir à temperaturas.
E transformar em dilatação, interações entre partículas, energias e campos.
Estado dos padrões de variações e efeitos variacionais.
Estado de incerteza dos fenômenos e entre as suas interações.
E outros estados de matéria, energia, momentum, tipos de inércia [como de inércia potencial de energias magnética, elétrica, forte e fraca, dinâmica, geométrica [côncava, convexa e plana] em sistema.
E que todos estes tipos de estados tendem a ter ações de uns sobre os outros, formando um aglomerado de fenômenos de efeitos na produção de novas causas. E de efeitos variacionais de uns sobre os outros, ou seja, um sistema integrado.
Sobre padrões de entropia.
Mesmo havendo uma desordem, esta desordem segue alguns parâmetros futuros e que dependem de condições dos estados de Graceli, ou seja, a desordem segue alguns padrões e ordens conforme avança e passa por fases e agentes fenomênicos, estruturais e geométricos.
Porem, a reversibilidade se torna impossível, aumenta a instabilidade e as incertezas de posição, intensidade, variações, efeitos e outros fenômenos conforme as próprias intensidades de dilatações, e agentes e estados envolvidos.
Levando em consideração que mesmo havendo ordem não é possível a reversibilidade do estado e condições em que se encontravam a energia, matéria, momentum, inércias, dimensões, e outros agentes.
A temperatura pode voltar ao seu lugar e ao seu ponto inicial, mas não as estruturas das partículas, as intensidades infinitésimas de padrões de energias, e nem o grau de oscilações que a energias, as interações, as transformações que passam estas partículas e suas energias, estruturas e interações, e as interações e intensidades de grau de variação de cada agente.
Porem, a desordem é temporal, ou seja, com o passar do tempo outras ordens e padrões se afirmarão.
Sendo que também a entropia varia conforme intensidade de instabilidade por tempo. E tempo por intensidade de instabilidade.
Assim, segue efeitos variacionais e de incertezas por instabilidade de energia adicionada, e de tempo.
Ou seja, uma grande instabilidade e desordem em pouco tempo vai levar a uma grande e instável por mais tempo uma entropia.
Do que um grande tempo com pequena intensidade de instabilidade e energia adicionada num sistema ou numa variação térmica.
Ou mesmo numa variação eletromagnética, ou mesmo na condutividade.
Princípio tempo instabilidade de Graceli.
Assim, a desordem acaba por encontrar uma ordem se não acontecer nenhuma instabilidade novamente. Pois, as partículas e energias tendem a se reorganizar novamente conforme o passar do tempo, e esta reorganização segue um efeito progressivo em relação à desordem e tempo. Como os vistos acima.
Ou seja, aquela organização anterior não vai mais acontecer, pois, segue o princípio da irreversibilidade, mas outras organizações se formarão conforme avança o tempo de estabilidade.
Estados térmico.
Estado quântico.
De dilatação.
De entropia.
De potencia de entropia e relação com dilatação.
De magnetismo [correntes, momentum e condutividades]..
De eletricidade [correntes, momentum e condutividades].
De condutividade.
De mometum e fluxos variados.
De potencial inercial da matéria e energia.
De transformação.
De comportamento de cargas e interações com elétrons.
De emaranhamentos e transemaranhamentos.
De paridades e transparidades.
De radiação.
Radioatividade.
De radioisótopos.
De relação entre radioatividade, radiação, eletromagnetismo e termoentropia.
De capacidade e potencialidade de resistir a pressão, a capacidade de resistir a pressão e transformar em entropia e momentum.
De resistir à temperaturas.
E transformar em dilatação, interações entre partículas, energias e campos.
Estado dos padrões de variações e efeitos variacionais.
Estado de incerteza dos fenômenos e entre as suas interações.
E outros estados de matéria, energia, momentum, tipos de inércia [como de inércia potencial de energias magnética, elétrica, forte e fraca, dinâmica, geométrica [côncava, convexa e plana] em sistema.
E que todos estes tipos de estados tendem a ter ações de uns sobre os outros, formando um aglomerado de fenômenos de efeitos na produção de novas causas. E de efeitos variacionais de uns sobre os outros, ou seja, um sistema integrado.
Sobre padrões de entropia.
Mesmo havendo uma desordem, esta desordem segue alguns parâmetros futuros e que dependem de condições dos estados de Graceli, ou seja, a desordem segue alguns padrões e ordens conforme avança e passa por fases e agentes fenomênicos, estruturais e geométricos.
Porem, a reversibilidade se torna impossível, aumenta a instabilidade e as incertezas de posição, intensidade, variações, efeitos e outros fenômenos conforme as próprias intensidades de dilatações, e agentes e estados envolvidos.
Levando em consideração que mesmo havendo ordem não é possível a reversibilidade do estado e condições em que se encontravam a energia, matéria, momentum, inércias, dimensões, e outros agentes.
A temperatura pode voltar ao seu lugar e ao seu ponto inicial, mas não as estruturas das partículas, as intensidades infinitésimas de padrões de energias, e nem o grau de oscilações que a energias, as interações, as transformações que passam estas partículas e suas energias, estruturas e interações, e as interações e intensidades de grau de variação de cada agente.
Porem, a desordem é temporal, ou seja, com o passar do tempo outras ordens e padrões se afirmarão.
Sendo que também a entropia varia conforme intensidade de instabilidade por tempo. E tempo por intensidade de instabilidade.
Assim, segue efeitos variacionais e de incertezas por instabilidade de energia adicionada, e de tempo.
Ou seja, uma grande instabilidade e desordem em pouco tempo vai levar a uma grande e instável por mais tempo uma entropia.
Do que um grande tempo com pequena intensidade de instabilidade e energia adicionada num sistema ou numa variação térmica.
Ou mesmo numa variação eletromagnética, ou mesmo na condutividade.
Princípio tempo instabilidade de Graceli.
Assim, a desordem acaba por encontrar uma ordem se não acontecer nenhuma instabilidade novamente. Pois, as partículas e energias tendem a se reorganizar novamente conforme o passar do tempo, e esta reorganização segue um efeito progressivo em relação à desordem e tempo. Como os vistos acima.
Ou seja, aquela organização anterior não vai mais acontecer, pois, segue o princípio da irreversibilidade, mas outras organizações se formarão conforme avança o tempo de estabilidade.
as dimensões categorias podem ser divididas em cinco formas diversificadas.
tipos, níveis, potenciais, tempo de ação, especificidades de transições de energias, de fenômenos, de estados de energias, físicos [estruturais], de fenômenos, estados quântico, e outros.
= entropia reversível
matriz categorial Graceli.
tipos, níveis, potenciais, tempo de ação, especificidades de transições de energias, de fenômenos, de estados de energias, físicos [estruturais], de fenômenos, estados quântico, e outros.
paradox of the system of ten dimensions and categories of Graceli.
a four-dimensional system can not define all the energies, changes of structures, states and phenomena within a structure, that is why there are ten or more dimensions, I have developed and I work with ten, but nature certainly goes beyond ten, with this we move to a decadimensional and categorial universe.
that is, categories ground the variables of phenomena and their interactions and transformations.
and with this we do not have a relationship with mass, but with structure, therefore, a structure carries with it much more than mass, since also mass is related to forces, inertia, resistances and energies.
but structures are related to transitions of physical states, quantum, energies, phenomena, and others.
as well as transitions of energies, phenomena, categories and dimensions.
paradoxo do sistema de dez dimensões e categorias de Graceli.
um sistema de quatro dimensões não tem como definir todas as energias, mudanças de estruturas, estados e fenômenos dentro de uma estrutura, por isto se tem dez ou mais dimensões, desenvolvi e trabalho com dez, mas a natureza com certeza vai alem das dez, com isto caminhamos para um universo decadimensional e categorial.
ou seja, as categorias fundamentam as variáveis dos fenõmenos e suas interações e transformações.
e com isto não se tem uma relação com massa, mas com estrutura, pois, uma estrutura carrega consigo muito mais do que massa, uma vez também que massa está relacionado com forças, inércia, resistências e energias.
mas estruturas está relacionado com transições de estados físicos, quântico, de energias, de fenômenos, e outros.
como também transições de energias, fenômenos, categorias e dimensões.
a four-dimensional system can not define all the energies, changes of structures, states and phenomena within a structure, that is why there are ten or more dimensions, I have developed and I work with ten, but nature certainly goes beyond ten, with this we move to a decadimensional and categorial universe.
that is, categories ground the variables of phenomena and their interactions and transformations.
and with this we do not have a relationship with mass, but with structure, therefore, a structure carries with it much more than mass, since also mass is related to forces, inertia, resistances and energies.
but structures are related to transitions of physical states, quantum, energies, phenomena, and others.
as well as transitions of energies, phenomena, categories and dimensions.
paradoxo do sistema de dez dimensões e categorias de Graceli.
um sistema de quatro dimensões não tem como definir todas as energias, mudanças de estruturas, estados e fenômenos dentro de uma estrutura, por isto se tem dez ou mais dimensões, desenvolvi e trabalho com dez, mas a natureza com certeza vai alem das dez, com isto caminhamos para um universo decadimensional e categorial.
ou seja, as categorias fundamentam as variáveis dos fenõmenos e suas interações e transformações.
e com isto não se tem uma relação com massa, mas com estrutura, pois, uma estrutura carrega consigo muito mais do que massa, uma vez também que massa está relacionado com forças, inércia, resistências e energias.
mas estruturas está relacionado com transições de estados físicos, quântico, de energias, de fenômenos, e outros.
como também transições de energias, fenômenos, categorias e dimensões.
= entropia reversível
postulado categorial e decadimensional Graceli.
TUDO QUE ESTÁ RELACIONADO COM ENERGIA, ESTRUTURAS, FENÔMENOS E DIMENSÕES ESTÁ INSERIDO NO SISTEMA DECADIMENSIONAL E CATEGORIAL GRACELI.
todo sistema decadimensional e categorial é um sistema transcendente e indeterminado.
TUDO QUE ESTÁ RELACIONADO COM ENERGIA, ESTRUTURAS, FENÔMENOS E DIMENSÕES ESTÁ INSERIDO NO SISTEMA DECADIMENSIONAL E CATEGORIAL GRACELI.
todo sistema decadimensional e categorial é um sistema transcendente e indeterminado.
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D
1] Cosmic space.
2] Cosmic and quantum time.
3] Structures.
4] Energy.
5] Phenomena.
6] Potential.
7] Phase transitions of physical [amorphous and crystalline] states and states of energies and phenomena of Graceli.
8] Types and levels of magnetism [in paramagnetic, diamagnetic, ferromagnetic] and electricity, radioactivity [fissions and fusions], and light [laser, maser, incandescence, fluorescence, phosphorescence, and others.
9] thermal specificity, other energies, and structure phenomena, and phase transitions.
10] action time specificity in physical and quantum processes.
2] Cosmic and quantum time.
3] Structures.
4] Energy.
5] Phenomena.
6] Potential.
7] Phase transitions of physical [amorphous and crystalline] states and states of energies and phenomena of Graceli.
8] Types and levels of magnetism [in paramagnetic, diamagnetic, ferromagnetic] and electricity, radioactivity [fissions and fusions], and light [laser, maser, incandescence, fluorescence, phosphorescence, and others.
9] thermal specificity, other energies, and structure phenomena, and phase transitions.
10] action time specificity in physical and quantum processes.
Sistema decadimensional Graceli.
1]Espaço cósmico.
2]Tempo cósmico e quântico.
3]Estruturas.[isótopos, estrutura eletrônica, elementos químicos, amorfos e cristalinos, e, outros.
4]Energias.
5]Fenômenos.
6]Potenciais., e potenciais de campos, de energias, de transições de estruturas e estados físicos, quãntico, e estados de fenômenos e estados de transições, transformações e decaimentos.
7]Transições de fases de estados físicos [amorfos e cristalinos] e estados de energias e fenômenos de Graceli.
8]Tipos e níveis de magnetismo [em paramagnéticos, diamagnético, ferromagnéticos] e eletricidade, radioatividade [fissões e fusões], e luz [laser, maser, incandescências, fluorescências, fosforescências, e outros.
9] especificidade térmica, de outras energias, e fenômenos das estruturas, e transições de fases.
10] especificidade de tempo de ações em processos físicos e quântico.
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
D
Matriz categorial de Graceli.
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
Dl
Tipos, níveis, potenciais, tempo de ação, temperatura, eletricidade, magnetismo, radioatividade, luminescências, dinâmicas, estruturas, fenômenos, transições de fenômenos e estados físicos, e estados de energias, dimensões fenomênicas de Graceli.
[estruturas: isótopos, partículas, amorfos e cristalinos, paramagnéticos, dia, ferromagnéticos, e estados [físicos, quântico, de energias, de fenômenos, de transições, de interações, transformações e decaimentos, emissões e absorções, eletrostático, condutividade e fluidez]].
trans-intermecânica de supercondutividade no sistema categorial de Graceli.
EPG = d [hc] [T / IEEpei [pit] = [pTEMRLD] and [fao] [itd] [iicee] tetdvd [pe] cee [caG].]
p it = potentials of interactions and transformations.
Temperature divided by isotopes and physical states and potential states of energies and isotopes = emissions, random wave fluxes, ion interactions, charges and energies structures, tunnels and entanglements, transformations and decays, vibrations and dilations, electrostatic potential, conductivities, entropies and enthalpies. categories and agents of Graceli.
h e = quantum index and speed of light.
[pTEMRlD] = THERMAL, ELECTRICAL, MAGNETIC, RADIOACTIVE, Luminescence, DYNAMIC POTENTIAL] ..
EPG = GRACELI POTENTIAL STATUS.
[pTFE] = POTENCIAL DE TRANSIÇÕES DE FASES DE ESTADOS FÍSICOS E DE ENERGIAS E FANÔMENOS [TRANSIÇÕES DE GRACELI]
, [pTEMRLD] [hc] [pI] [PF] [pIT][pTFE] [CG].
EPG = d [hc] [T / IEEpei [pit] = [pTEMRLD] and [fao] [itd] [iicee] tetdvd [pe] cee [caG].]
p it = potentials of interactions and transformations.
Temperature divided by isotopes and physical states and potential states of energies and isotopes = emissions, random wave fluxes, ion interactions, charges and energies structures, tunnels and entanglements, transformations and decays, vibrations and dilations, electrostatic potential, conductivities, entropies and enthalpies. categories and agents of Graceli.
h e = quantum index and speed of light.
[pTEMRlD] = THERMAL, ELECTRICAL, MAGNETIC, RADIOACTIVE, Luminescence, DYNAMIC POTENTIAL] ..
EPG = GRACELI POTENTIAL STATUS.
[pTFE] = POTENCIAL DE TRANSIÇÕES DE FASES DE ESTADOS FÍSICOS E DE ENERGIAS E FANÔMENOS [TRANSIÇÕES DE GRACELI]
, [pTEMRLD] [hc] [pI] [PF] [pIT][pTFE] [CG].

























 = entropia reversível
= entropia reversível